Ubiquitination and Gamategenesis
哺乳動物の生殖細胞の分化過程におけるユビキチン化の役割
■ ユビキチン化酵素MARCH7の精子頭部における局在解析と機能解析 (Histochem. Cell Biol. 139, Zhao et al.)
精子の頭部には遺伝情報を格納した核と,受精に必要な分解酵素群が詰まった小胞(アクロソーム)が主要な構造体であるが,これらの構造の形成とポジショニングの決定には周辺部の細胞骨格様の構造体が重要な働きをもつことが分かっている。 現在も,この周辺構造体の分子実体や機能については不明な点が多く残されている。本研究では,下記のMARCH10によく似た構造をもつユビキチン化酵素MARCH7が精巣に高発現して,精子の核およびアクロソームの周辺構造体の構成成分であることを明らかにしている。 精子頭部の構造形成と維持にユビキチン化が役割をもつことはこれまであまり知られていなかったので,本研究の結果は精子形成の分子機構を考える上で大変興味深い。
MARCH7 E3 ubiquitin ligase is highly expressed in developing spermatids of rats and its possible involvement in head and tail formation. Histochem. Cell Biol.139(3), 447-460, 2013 PMID: 23104140Zhao B, Ito K, Iyengar PV, Hirose S, Nakamura N.
Spermatogenesis is a highly complicated metamorphosis process of male germ cells. Recent studies have provided evidence that the ubiquitin-proteasome system plays an important role in sperm head shaping, but the underlying mechanism is less understood. In this study, we localized membrane-associated RING-CH (MARCH)7, an E3 ubiquitin ligase, in rat testis. Northern blot analysis showed that March7 mRNA is expressed ubiquitously but highly in the testis and ovary. In situ hybridization of rat testis demonstrated that March7 mRNA is expressed weakly in spermatogonia and its level is gradually increased as they develop. Immunohistochemical analysis detected MARCH7 protein expression in spermiogenic cells from late round spermatids to elongated spermatids and in epididymal spermatozoa. Moreover, MARCH7 was found to be localized to the caudal end of the developing acrosome of late round and elongating spermatids, colocalizing with β-actin, a component of the acroplaxome. In addition, MARCH7 was also detected in the developing flagella and its expression levels were prominent in elongated spermatids. We also showed that MARCH7 catalyzes lysine 48 (K48)-linked ubiquitination. Immunolocalization studies revealed that K48-linked ubiquitin chains were detected in the heads of elongating spermatids and in the acrosome/acroplaxome, neck, midpiece and cytoplasmic lobes of elongated spermatids. These results suggest that MARCH7 is involved in spermiogenesis by regulating the structural and functional integrity of the head and tail of developing spermatids.
■ MARCH11の基質分子の同定 (Histochem. Cell Biol. 137, Yogo et al.)
新規の膜貫通タンパク質ファミリーであるSAMTはMARCH11によるユビキチン化の標的基質であることを明らかにした。今後,SAMTの機能解析や細胞内輸送の機序を解析が進めば,精子形成中の精子細胞におけるユビキチン化を介したタンパク質輸送の実態解明に近づくことが期待できる。(静岡大学農学部 与語圭一郎先生との共同研究)
Identification of SAMT family proteins as substrates of MARCH11 in mouse spermatids. Histochem. Cell Biol. 137(1), 53-65, 2012 PMID: 22075566Yogo K, Tojima H, Ohno JY, Ogawa T, Nakamura N, Hirose S, Takeya T, Kohsaka T.
MARCH11, a RING-finger transmembrane ubiquitin ligase, is predominantly expressed in spermatids and localized to the trans-Golgi network (TGN) and multivesicular bodies (MVBs). Because ubiquitination acts as a sorting signal of cargo proteins, MARCH11 has been postulated to mediate selective protein sorting via the TGN-MVB pathway. However, the physiological substrate of MARCH11 has not been identified. In this study, we have identified and characterized SAMT1, a member of a novel 4-transmembrane protein family, which consists of four members. Samt1 mRNA and its expression product were found to be specific to the testis and were first detected in germ cells 25 days after birth in mice. Immunohistochemical analysis further revealed that SAMT1 was specifically expressed in haploid spermatids during the cap and acrosome phases. Confocal microscopic analysis showed that SAMT1 co-localized with MARCH11 as well as with fucose-containing glycoproteins, another TGN/MVB marker, and LAPM2, a late endosome/lysosome marker. Furthermore, we found that MARCH11 could increase the ubiquitination of SAMT1 and enhance its lysosomal delivery and degradation in an E3 ligase activity-dependent manner. In addition, the C-terminal region of SAMT1 was indispensable for its ubiquitination and proper localization. The other member proteins of the SAMT family also showed similar expression profile, intracellular localization, and biochemical properties, including ubiquitination by MARCH11. These results suggest that SAMT family proteins are physiological substrates of MARCH11 and are delivered to lysosomes through the TGN-MVB pathway by a ubiquitin-dependent sorting system in mouse spermatids.
■ マウス精子形成過程で発現するミトコンドリアタンパク質の同定 (J Biol Chem. 286, 39082-39090, Iyengar et al.)
精子の尾部(鞭毛)は精子の運動性の獲得に重要であり,鞭毛の中心部分には運動性の現動力を生み出すためのモータータンパク質と微小管構造から成る軸糸という構造があり,周辺部には細胞骨格様の構造体が軸糸を取り囲むように存在して鞭毛の構造的強度と柔軟性を与えている。鞭毛の構造がどのようなタンパク質で構成され,どのようにして構築されていくのかについてはほとんど分かっていない。鞭毛の構成分子の遺伝子変異により精子形成や精子運動性の異常が引き起こされ不妊の原因になることも報告されており,鞭毛形成の分子機序の理解は重要であるといえる。私たちはMARCH10が形成段階の途中である鞭毛の周辺構造体に高発現して,精子形成が終了するころには消失することを明らかにした。このMARCH10はユビキチン化酵素でありタンパク質分解を促進するユビキチン鎖の形成を触媒を行うことが示唆されたため,鞭毛構成分子のタンパク質の品質管理や発現調節を行うことで正常な鞭毛形成進行を助けていることが示唆された。
Membrane-Associated RING-CH 10 (MARCH10 Protein) is a Microtubule-associated E3 Ubiquitin Ligase of the Spermatid Flagella. J Biol Chem. 286(45), 39082-39090, 2011 PMID: 21937444Iyengar PV, Hirota T, Hirose S, Nakamura N.
Spermiogenesis is a complex and dynamic process of a metamorphosis of spermatids into spermatozoa. There is a great deal which is still unknown regarding the regulatory mechanisms for the formation of the sperm flagellum. In the present study, we determined that the membrane-associated RING-CH 10 (March10) gene is predominantly expressed in rat testis. We isolated two March10 isoforms encoding MARCH10a and MARCH10b, which are generated by alternative splicing. MARCH10a is a long, RING-finger protein, and MARCH10b is a short, RING-finger-less protein. Immunohistochemical staining revealed that the MARCH10 proteins are specifically expressed in elongating and elongated spermatids, and the expression is absent in epididymal spermatozoa. MARCH10 immunoreactivity was observed in the cytoplasmic lobes as well as the principal piece and annulus of the flagella. When overexpressed in COS7 cells, MARCH10a was localized along the microtubules, whereas MARCH10b was distributed throughout the cytoplasm. An in vitro microtubule cosedimentation assay showed that MARCH10a is directly associated with microtubules. An in vitro ubiquitination assay demonstrated that the RING-finger domain of MARCH10a exhibits an E3 ubiquitin ligase activity along with the E2 ubiquitin conjugating enzyme UBE2B. Moreover, MARCH10a undergoes proteasomal degradation by autoubiquitination in transfected COS7 cells, but this activity was abolished upon microtubule disassembly. These results suggest that MARCH10 is involved in spermiogenesis by regulating the formation and maintenance of the flagella in developing spermatids.
精子は遺伝情報を詰め込んだ頭部と卵子まで泳いでいくのに必要な尾部(鞭毛)から構成されている。尾部はさらに鞭毛運動に必要なエネルギーを供給するミトコンドリアをたくさん持つ前半部分(midpiece)と運動性の高い後半部分(principal piece)に分けられる。これら2つの部分は機能的にも構造的にも異なっているが,どのようにして形作られていくのか,どんなタンパク質が働いているのかについてはあまりよくわかっていない。MARCH10は非膜貫通型のE3ユビキチンリガーゼであり,分化後期の精子細胞のprincipal pieceに多く局在していることを明らかにした。超高解像度顕微鏡観察によってMARCH10がチューブリンなどで構成される軸糸に接している構造体に存在することが分かった。また,MARCH10の酵素活性がチューブリン細胞骨格との結合に依存するというユニークな性質をもつことを認めた。おそらくMARCH10は尾部の構成成分の分解や修飾を行うことで精子尾部の形成にはたらいていることが考えられる。
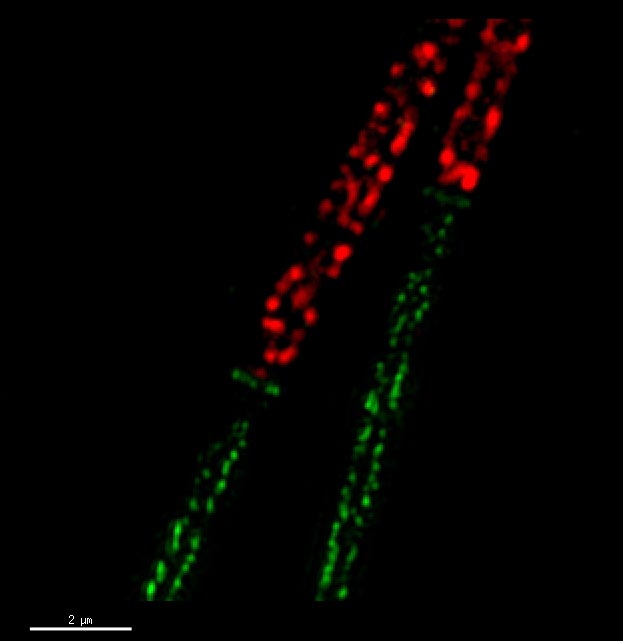
ラットの精子細胞尾部の蛍光染色像。MARCH10(緑)がミトコンドリア(赤)が存在しない部分にあることが分かる。
■ マウス精子形成過程で発現するミトコンドリアタンパク質の同定 (Biol. Reprod. 80, 762-770, Aihara et al.)
ミトコンドリアの融合・分裂因子の相互作用因子の探索を行う過程で,GGNBP1を同定した。マウスGGNBP1は精巣特異的な発現を示し,分化途中の精母細胞と精子細胞に高発現してミトコンドリアに局在していることを認めた。培養細胞COS-7を用いた解析から,GGNBP1はミトコンドリアの膜間スペースに局在して,ミトコンドリアの分裂を促進することが分かった。精子形成時にミトコンドリアはその形態・局在・数を変化させていることが知られている。特に,多いエネルギー(ATP)を必要とする減数分裂時にはミトコンドリアの数が増加しその膜構造が変化することが報告されていることから,GGNBP1はこのミトコンドリアの形態変化に関与して精子形成をたすけていることが考えられる。
A Novel Potential Role for Gametogenetin-Binding Protein 1 (GGNBP1) in Mitochondrial Morphogenesis During Spermatogenesis of Mice. Biol. Reprod. 80(4), 762-770. 2009 PMID: 19208545Aihara T, Nakamura N, Honda S, and Hirose S.
Mitochondria are dynamic organelles that undergo fusion, fission, and translocation. The dynamic property is essential for establishing energy-consuming biological processes including cellular differentiation. Early ultrastructural studies have shown that mitochondria of mammalian spermatogenic cells dramatically change their number, size, distribution, and internal structure. However its regulatory mechanism is largely unknown. In course of searching for molecules involved in the mitochondrial morphogenesis in spermatogenesis, we identified mouse gametogenetin-binding protein 1 (GGNBP1), a DUF1055 domain-containing protein of unknown function, as a mitochondrial protein. When GGNBP1 was expressed in COS7 cells, it was localized in the intermembrane space and induced an extensive fragmentation of mitochondria in the manner dependent on the activity of the mitochondrial fission factor DNM1L. Deletion mutant analyses demonstrated that the N-terminal region is required for its mitochondrial targeting and the C-terminal region including the DUF1055 domain is responsible for the mitochondrial fragmentation activity. Immunohistochemistry of mouse testis revealed that GGNBP1 is highly expressed in the late pachytene spermatocytes and early round spermatids. However a subcellular fractionation study showed that it is localized to not only mitochondria but also other membranous compartments in vivo. These results suggest that GGNBP1 is involved in spermatogenesis by modifying mitochondrial dynamics and morphology.
■ タンパク質の膜輸送経路上に高発現するユビキチン化酵素MARCH-XIの同定 (J Biol Chem. 282, 24806-24815, Morokuma et al.)
精原細胞が精子へと分化する過程では非常にダイナミックで複雑な細胞の形態変化が起こる。特に精子特有のオルガネラである先体胞(アクロソーム)の形成時には,おびただしい数の輸送小胞がゴルジ体から生成され,アクロソームの構成成分を運ぶことが解剖学的な研究で明らかにされている。このゴルジ体→アクロソーム経路の他に,エンドゾームの一つであるmultivesicular body(MVB)への輸送経路も存在している。したがって,ゴルジ体から出ていくタンパク質は,この二つの経路の一方をとるように正しく仕分けられなくてはならない。最近の酵母の解析からユビキチンがゴルジ体からMVBへの選別輸送のシグナルとして働くことが知られている。また,精子細胞のTGN付近の小胞の膜タンパク質がユビキチン化されていることを報告されている(Haraguchi et al., J Histochem Cytochem 52 1393-1403; 2004)。これは精子細胞においてもユビキチン化による仕分けシステムが存在することを示唆しているが,このユビキチン化を触媒するE3酵素の分子実体については不明である。私たちは,MARCH-XIがアクロソーム形成時の精子細胞に多量に発現し,ゴルジ体由来の輸送小胞とMVBに局在すること,また,この小胞内でユビキチン化タンパク質と相互作用しているらしいことを明らかにした。さらに,MARCH-XIがクラスリン被膜のアダプター分子であるAP-1と共局在し,相互作用することを認めた。AP-1は体細胞では TGN-エンドゾーム間における輸送分子の選別に働くことが知られているので,上記の結果は,MARCH-XIがAP-1と協力してTGN-MVB経路の選別輸送の制御に働くE3酵素であり,精子形成に関与している可能性が高いことを示すものといえる。
MARCH-XI, a Novel Transmembrane Ubiquitin Ligase Implicated in Ubiquitin-dependent Protein Sorting in Developing Spermatids. J Biol Chem. 282(34), 24806-24815. 2007 PMID: 17604280Morokuma Y, Nakamura N, Kato A, Notoya M, Yamamoto Y, Sakai Y, Fukuda H, Yamashina S, Hirata Y, Hirose S.
A mechanism by which ubiquitinated cargo proteins are sorted into multivesicular bodies (MVBs) from plasma and trans-Golgi network (TGN) membranes is well established in yeast and mammalian somatic cells. However, the ubiquitin-dependent sorting pathway has not been clearly defined in germ cells. In this study we identified a novel member of the transmembrane RING-finger family of proteins, termed membrane-associated RING-CH (MARCH)-XI, that is expressed predominantly in developing spermatids and weakly in brain and pituitary. MARCH-XI possesses an E3 ubiquitin ligase activity that targets CD4 for ubiquitination. Immunoelectron microscopy of rat round spermatids showed that MARCH-XI is localized to TGN-derived vesicles and MVBs. Fluorescence staining of rat round spermatids and immunoprecipitation of rat testis demonstrated that MARCH-XI forms complexes with the adaptor protein complex-1 and with fucose-containing glycoproteins including ubiquitinated forms. Furthermore, the C-terminal region of MARCH-XI mediates its interaction with mu1-adaptin and Veli through a tyrosine-based motif and a PDZ binding motif, respectively. Our data suggest that MARCH-XI acts as a ubiquitin ligase with a role in ubiquitin-mediated protein sorting in the TGN-MVB transport pathway, which may be involved in mammalian spermiogenesis.
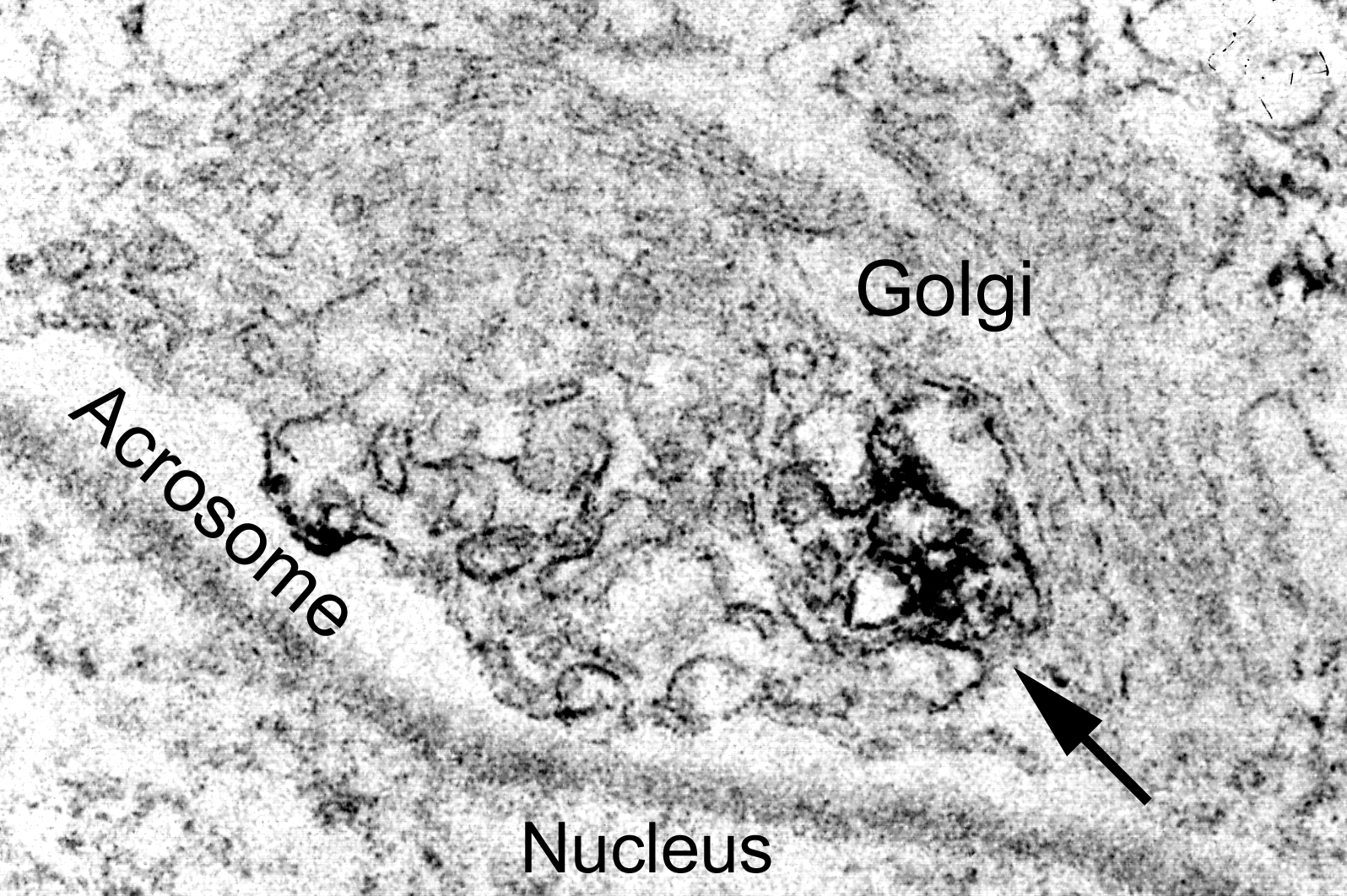
ラットの精子細胞の免疫電顕画像。MARCH-XIは精子細胞のトランスゴルジから作られる小胞の膜上にぎっしり詰まっている(矢印)。