研究内容
テーマ1.接着型Gタンパク質共役型受容体ADGRF5の生理機能とその機能不全による病態発症機構の解明 (テーマ2はこちら)
Gタンパク質共役型受容体(G-protein-coupled receptor: GPCR)はヒトに約800種類存在し,光,匂い,ホルモン,神経伝達物質,イオンなど様々な細胞外刺激情報を,cAMP、カルシウム、イノシトールリン酸などのセカンドメッセンジャーに変換して細胞内に伝達することで細胞応答を誘導している。GPCRの生理機能は感覚受容,神経伝達,内分泌,代謝,免疫応答,血圧調節など多岐にわたっており生体の恒常性維持に不可欠な存在である。したがって,GPCRの機能異常は多種多様な疾患を引き起こすことが知られており,現在,GPCRを標的とする医薬品の開発が進められている。個々のGPCRがどのような外部刺激を受容し、その情報をどのようにして細胞内に伝達して、どのような細胞応答を誘導するのかを分子レベルで明らかにすることは,基礎研究の観点のみならず疾患の予防法や治療法の開発にとって非常に重要である。GPCRはいくつかのグループに分類でき,そのひとつに接着型GPCR(Adhesion GPCR,約30種類存在する)がある。Adhesion GPCRは、GPCRに共通の膜7回貫通領域のほかに接着様ドメインを有する比較的大きなN末細胞外領域の存在が構造的特徴である。Adhesion GPCRは長い間リガンド未知のオーファン受容体とされていた。近年,多くのAdhesion GPCRでは,細胞外領域が細胞膜近傍で自己切断されるものの,細胞膜上で切断された膜7回貫通領域と相互作用して休止状態にあるが,何らかの刺激(細胞外マトリックスとの相互作用など)で構造変化を起こすことによって自己活性化を引き起こすことが報告されている。しかしながら,Adhesion GPCRの活性化および細胞内情報伝達のメカニズムや生理機能については十分に解明されていない。
私たちの研究室ではAdhesion GPCRのひとつであるAdhesion GPCR F5 (ADGRF5,別名でGPR116やIg-Heptaとも呼ばれる)の細胞内情報伝達機構と細胞機能の解明に取り組んでいます。ADGRF5の発見当初(90年代後半)は機能未知のオーファン受容体として日陰の存在でしたが,最近のAdhesion GPCR研究の進展によって多くの研究者に注目されるようになり研究報告が増えています。私たちはADGRF5のノックアウトマウスの表現型解析とin vitro解析を通して,ADGRF5が組織特異的な生理機能を有して生体の恒常性維持に重要な役割を果たすことを明らかにしてきました。以下に,主な研究成果について要約してありますのでご覧ください。特に,ADGRF5は全身の毛細血管に存在しており,私たちはこれまでに肺における免疫調節や腎臓における血液ろ過機能に関与することを明らかにしてきました。現在は,血管(血管内皮細胞)におけるADGRF5の活性化機構と細胞応答の解明に向けて研究を進めています。
主な研究テーマと成果
1. 肺の生体防御におけるADGRF5の役割
2. 脂肪組織での糖代謝調節におけるADGRF5の役割
3. 腎糸球体の構造維持におけるADGRF5の役割
1. 肺の生体防御におけるADGRF5の機能解明
肺には呼吸を介して進入してきた病原菌などの異物を除去する生体防御システム(自然免疫)が備わっている。最近のノックアウトマウスの解析から,ADGRF5がこの生体防御に深く関わっていることが明らかとなった。 ADGRF5の発信するシグナルとその作用機構を明らかにすることで,肺における免疫調節のしくみとその破綻による病態発症のメカニズムの理解につなげたい。
● 呼吸機能を支える肺サーファクタントの分泌調節
Lung surfactant levels are regulated by Ig-Hepta/GPR116 by monitoring surfactant protein D. PLoS ONE 8(7), e6945, 2013 PMID: 23922714肺は酸素と二酸化炭素の交換を行う生体の生存にとって重要な臓器である。このガス交換は,ブドウの房に似た肺胞で行われる。肺胞は二種類の上皮細胞からできていて,肺胞Ⅰ型細胞が9割程を占め,残りはⅡ型細胞であり,ヒトの肺胞の総表面積はテニスコート半分程の大きさにもなる。Ⅱ型細胞は少数派であるが,肺胞内の表面を薄く覆っている肺サーファクタントを生成して分泌しており,呼吸機能にとって非常に重要な役割を果たしている。肺サーファクタントは界面活性剤の一種であり,肺胞壁の表面張力を下げることで呼吸を助ける働きがある。肺サーファクタントが不足すると肺胞は潰れてしまい(虚脱),また,多すぎても呼吸困難になってしまうことから,その量は厳密に調節されていなければならない。肺サーファクタント量は,Ⅱ型細胞による分泌と肺胞マクロファージによる分解のバランスでコントロールされているが,どのようにして肺サーファクタント量をモニターし,その情報を合成・分解系に伝えているかは謎であった。
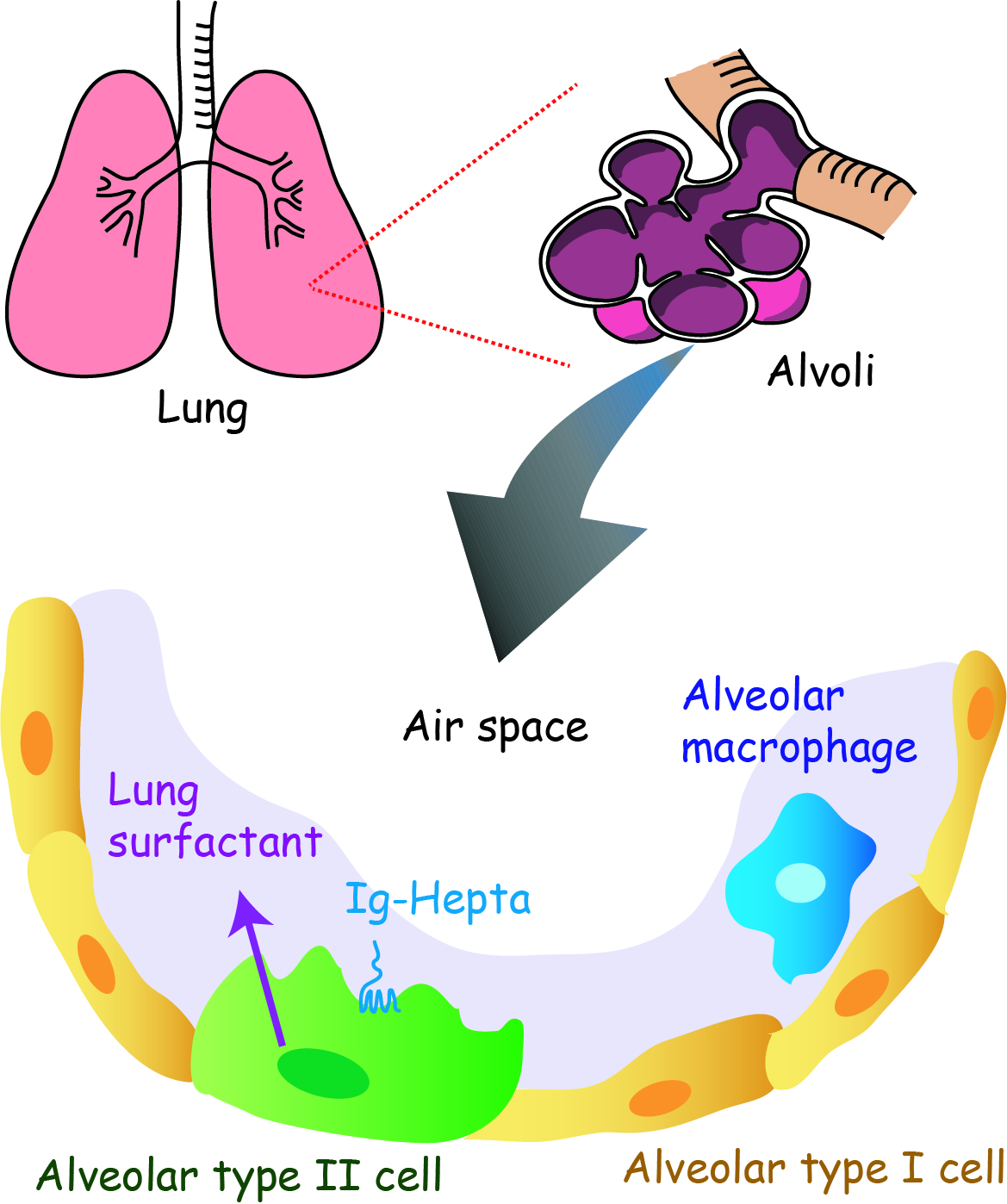
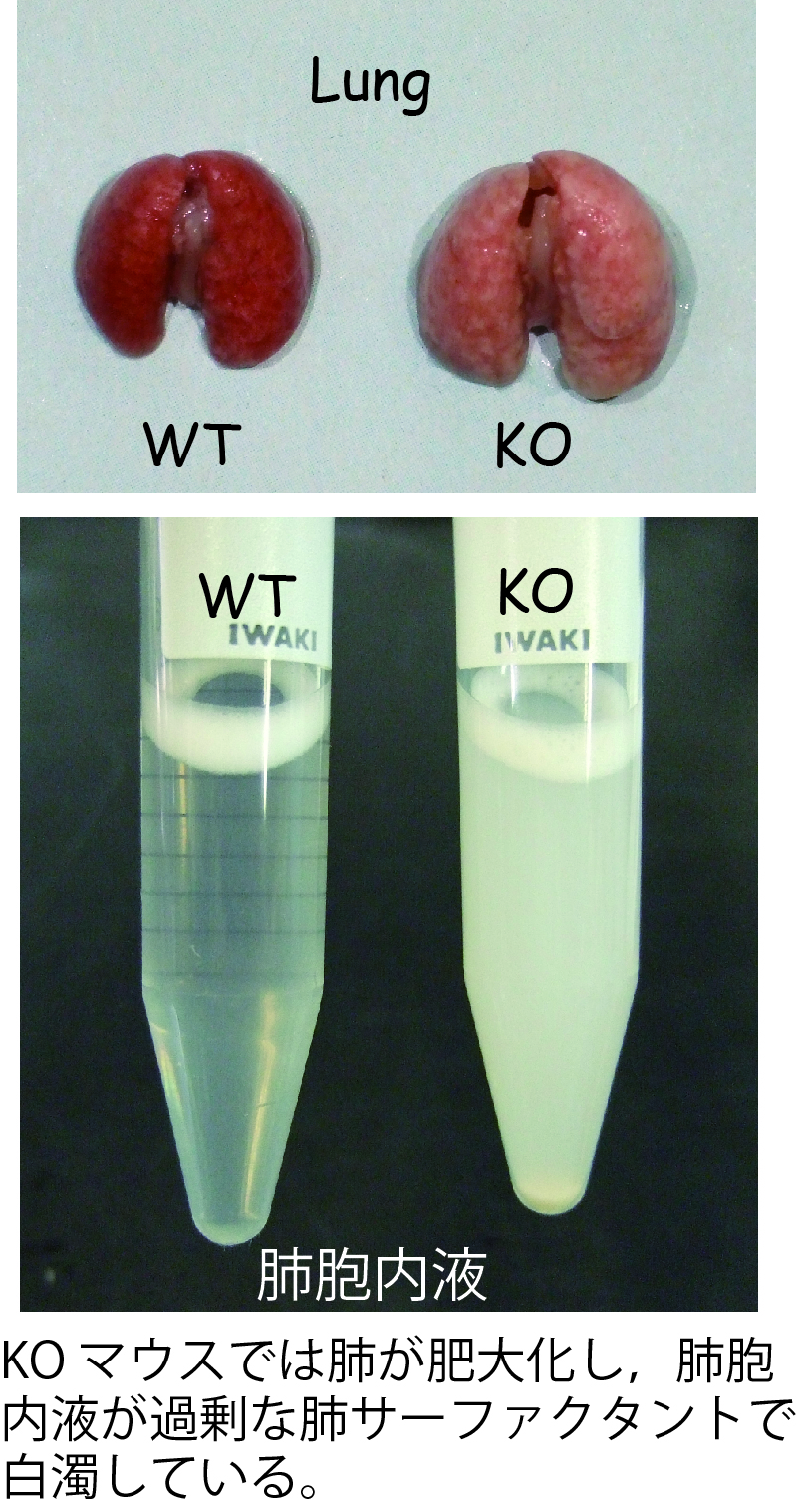
ADGRF5は,肺胞Ⅱ型細胞に高発現しているGPCRで細胞外領域が非常に長い(1000アミノ酸残基以上)という特徴を持つ。長い間,リガンドが未知のオーファンGPCRとして分類されてきた。最近,ADGRF5のノックアウト(KO)マウスを作製したところ,肺胞内を覆う肺サーファクタントが異常に蓄積することを見出した。KOマウスでは肺サーファクタントを構成する脂質の生合成が促進しているが,マクロファージによる分解に影響があまりないことが分かった。さらに,ADGRF5の細胞外領域と肺サーファクタントタンパク質SP-Dが結合することも明らかにした。以上の結果から,Ⅱ型細胞に発現するADGRF5は肺胞サーファクタント量をモニターしその分泌量を調節する分子センサーである可能性が高いといえる。
現在,ADGRF5がどのようにしてサーファクタント量をモニターしているのかというセンシングの仕組みと,サーファクタント合成系を制御する細胞内情報伝達の実体の解明を目指した解析を行っている。
● 肺の毛細血管における免疫調節
Targeted disruption of Ig-Hepta/Gpr116 causes emphysema-like symptoms that are associated with alveolar macrophage activation. J. Biol. Chem. 290, 11032-11040, 2015 PMID: 25778400Loss of the adhesion G-protein coupled receptor ADGRF5 in mice induces airway inflammation and the expression of CCL2 in lung endothelial cells. Respir. Res. 20, 11, 2019 PMID: 30654796
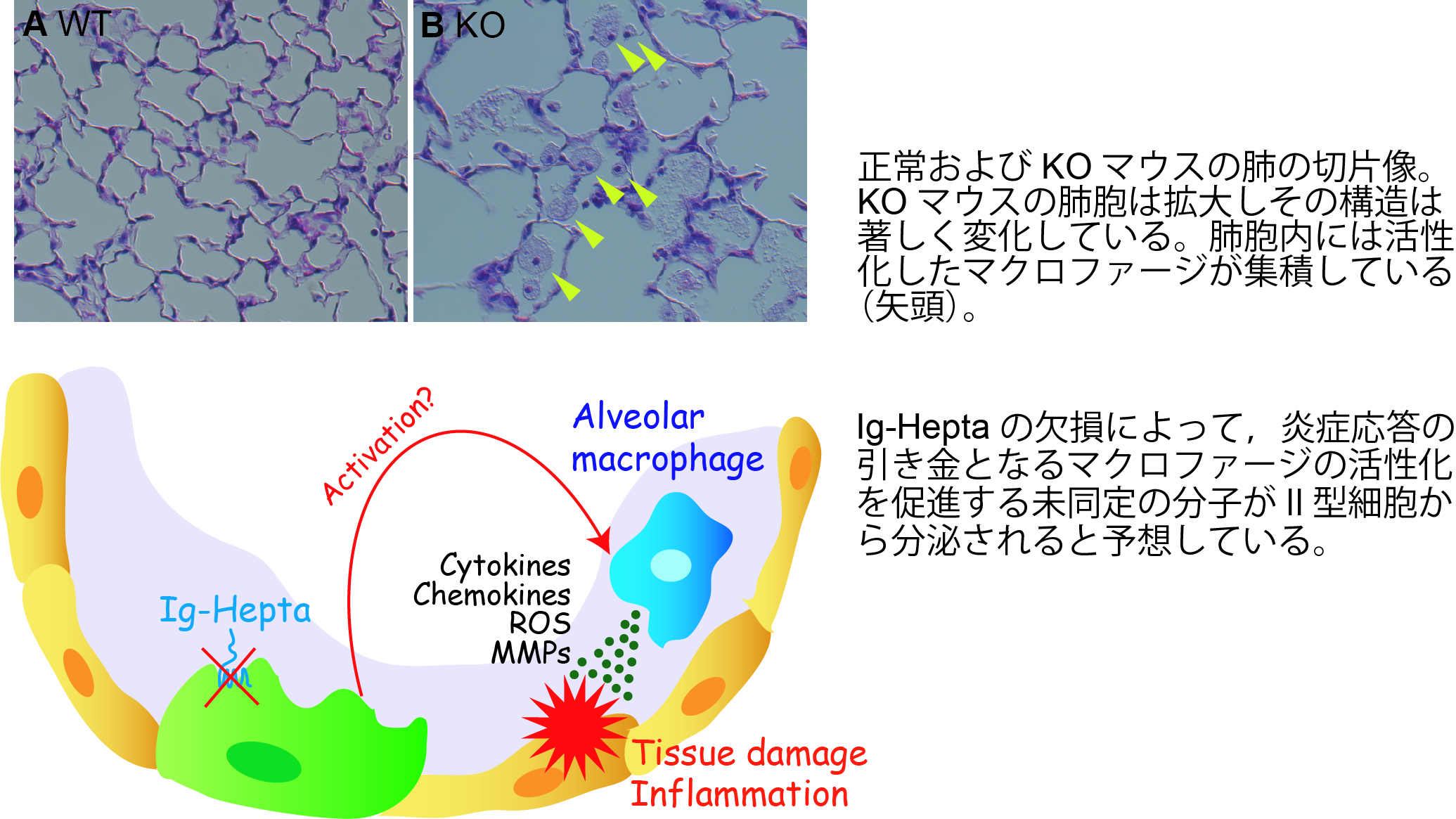
ADGRF5ノックアウトマウスの肺にはもう一つ興味深い表現型がある。KOマウスの肺胞内部には多数の肺胞マクロファージが集積し,多数のサイトカイン・ケモカイン,活性酸素種(ROS),基底膜分解酵素(MMP)を産生分泌していることが分かった。これら炎症性メディエーターは局所的な炎症反応を誘発し,肺胞壁の破壊につながることが知られており,実際にKOマウスの肺胞の構造は著しく変化している。これらの症状は,ヒトの慢性閉塞性肺疾患(COPD)の症状と良く似たところがあることから,ADGRF5が肺における免疫調節およびCOPDの発症機序に関与している可能性が高いものと考えている。(COPDは全世界における死因の上位に位置し,その発症機序や治療法が確立していない。) ADGRF5の発現は肺胞マクロファージには認められないことから,KOマウスのⅡ型細胞からマクロファージの活性化因子が分泌されており,正常マウスではこの分泌がADGRF5によって抑えられてマクロファージの活性化が負に制御されているのではないかと考えている。現在は,ADGRF5の下流に位置するマクロファージ活性化因子の同定を目指して解析を行っている。さらに、ADGRF5欠損によって肺胞だけでなく気管支においても炎症反応が生じていること、また、この肺の炎症応答が肺血管内皮細胞における炎症性メディエーターの産生亢進によって引き起こされている可能性を見出した。私たちはADGRF5が肺における免疫調節に関与しているものと考え、血管内皮細胞におけるADGRF5の役割について分子レベルで明らかにすることを目指しています。
2. 脂肪細胞における新たな糖代謝調節機構の発見
Orphan GPR116 mediates the insulin sensitizing effects of the hepatokine FNDC4 in adipose tissue.Nat. Commun. 12, 2999, 2021 PMID: 34016966ADGRF5は脂肪細胞にも発現しておりエネルギー代謝との関連が報告されていたが、その分子機序については明らかではなかった。私たちは肝臓から産生される新規ホルモンFNDC4が白色脂肪細胞のIg-Heptaと作用することによって、インスリン応答時のグルコース取り込み活性を亢進することを明らかにした。高脂肪食負荷による糖尿病予備モデルマウスを用いた解析で、FNDC4投与によってADGRF5依存的に耐糖能の改善傾向が認められた。したがって、ADGRF5は脂肪組織において糖代謝の制御分子として機能することが考えられ、その分子メカニズムを明らかにすることで2型糖尿病の発症機序や治療方法に対する新たな知見が得られるものと期待している。また、この新規ホルモンが他のADGRF5を発現する組織において何らかの役割を持つのかを明らかにするために解析中である。
3. 腎臓の血液ろ過フィルターの維持機構におけるADGRF5の役割の解明
Glomerular Endothelial Cell Receptor Adhesion G-Protein-Coupled Receptor F5 and the Integrity of the Glomerular Filtration Barrier. J Am Soc Nephrol in press, 2024 PMID: 38844335腎臓は、血中の老廃物や塩分をろ過して尿として排泄することで全身の体液の組成を一定に保つ役割を持つ。血液ろ過は腎臓の糸球体と呼ばれる毛細血管の壁を通して行われるが、この壁には血中の細胞やタンパク質を通過させない特殊なフィルター構造が備わっている。多くの腎疾患の要因として血液ろ過フィルターの異常が挙げられるが、フィルター構造が正常に働くよう維持する機構は謎のままであった。 本研究では、ADGRF5が血液ろ過フィルターを構成する糸球体内皮細胞に存在することを明らかにした。また、ADGRF5を欠損させたマウスでは、血液ろ過フィルターの構造が壊れて尿中にアルブミン(血中タンパク質の一種)が漏出し、腎機能が低下していることを発見した。さらに、ADGRF5が糸球体内皮細胞における遺伝子の働きを調節していることも明らかにした。 この成果は、血液ろ過フィルター異常による腎疾患の発症メカニズム解明に寄与することが期待される。
【ここから詳しい解説】私たちの腎臓は1日に150リットルもの血液をろ過して尿を生成している。糸球体でろ過された血液成分の約99%は水分、栄養素、ミネラルなど体にとって必要なものであるため、尿細管で血液に戻され(この作業を再吸収と呼ぶ)、最終的に残されたものが尿として排泄される。つまり、糸球体は血液成分を必要なものと不要なものとを区別せずに一度にまとめてろ過してしまい、その後で尿細管に必要な血液成分の回収をまかせていることになる。ただし、糸球体では血中の細胞とタンパク質はろ過しない。これを可能にしているのが糸球体ろ過障壁である。糸球体ろ過障壁は、糸球体内皮細胞とポドサイトの2種類の細胞と、これらの細胞に挟まれた糸球体基底膜の3層でできており、他の血管壁にはない非常にユニークな構造をしている(図1)。ポドサイトが形成する分子ふるい構造(スリット膜)と、基底膜や糸球体内皮細胞が持つ陰性荷電が連携して、血中の細胞やタンパク質が血管の壁を通り抜けるのを防いでいる。多くの腎疾患では、糸球体ろ過障壁に障害が認められるが、糸球体ろ過障壁が壊れるとバリア機能が低下して血中の細胞やタンパク質が漏出してしまう。その漏出量が多量になると、尿細管には多量のタンパク質を再吸収する能力はないため、血液中のタンパク質の濃度が下がり、浮腫(むくみ)などの症状を引き起こす(低タンパク血症)。また、漏出した細胞やタンパク質が糸球体や尿細管を損傷して、さらに腎機能を低下させる悪循環を引き起こす。したがって、糸球体ろ過障壁がどのようにして形作られて維持されているのか、その障害がどのようにして引き起こされるのかを明らかにすることは、腎疾患の原因解明および予防法や治療法の確立のために重要な課題といえる。それらの仕組みを解明しようとする研究がこれまでに数多く行われてきたが、糸球体ろ過障壁の非常に複雑かつ精緻な3層構造が解析を困難にさせていることもあり、全容解明に至ってはいない。
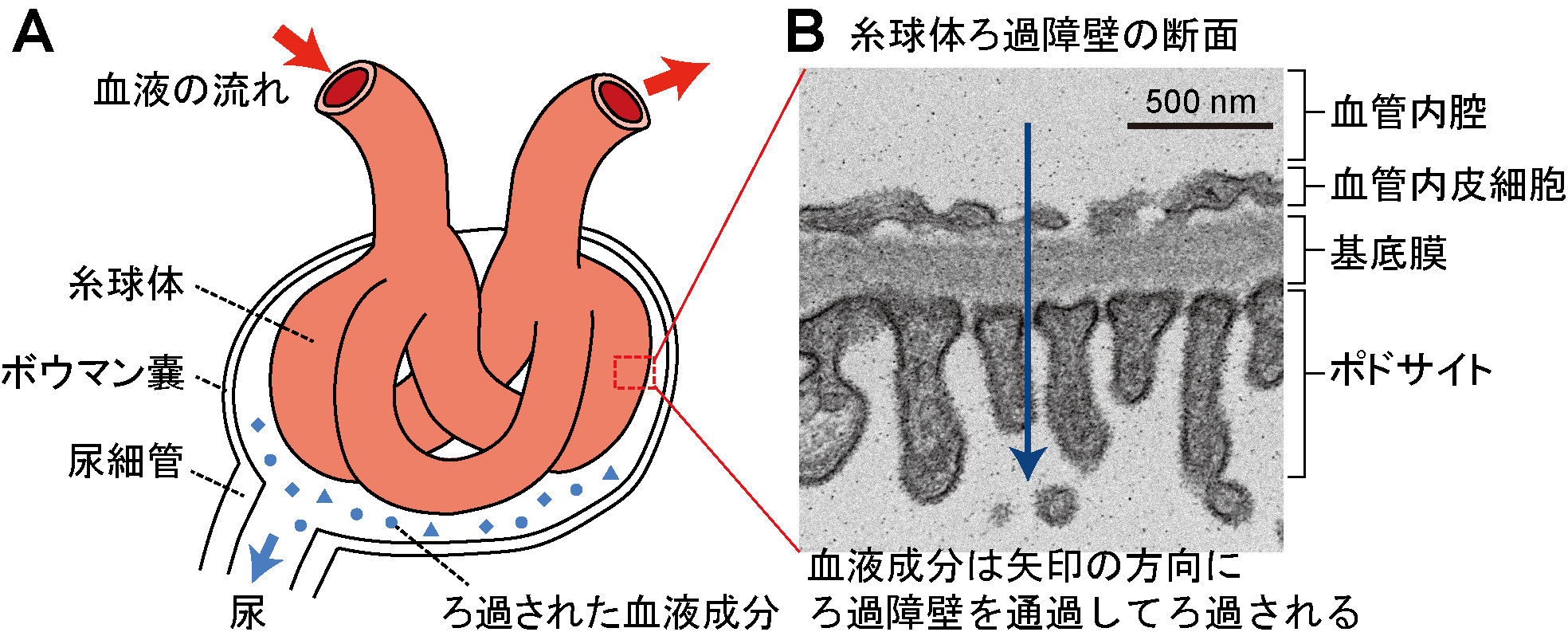
図1. 糸球体の模式図(A)とマウスの糸球体ろ過障壁の3層構造の電子顕微鏡写真(B)
私たちは、データベース解析から糖尿病性腎症の患者の糸球体におけるADGRF5の発現量が健常者の場合と比較して低いことを見出し、ADGRF5が糸球体の機能に重要な役割を果たすのではないかと予想した。そこで、まず、ADGRF5が糸球体ろ過障壁を構成する糸球体内皮細胞に存在することをマウスの腎臓サンプルを用いて明らかにした。次に、糸球体ろ過障壁におけるADGRF5の機能を探るために、ADGRF5を失った遺伝子改変マウス(ノックアウトマウス)の糸球体の構造に変化がないか顕微鏡観察を行って解析した。その結果、ADGRF5欠損マウスでは糸球体が大きくなっており(図2)、さらに、糸球体ろ過障壁が壊れている様子が観察された。具体的には、糸球体内皮細胞が基底膜から剥がれ、基底膜の断裂や肥厚といった明確な構造異常が起こっていた(図3)。また、尿や血液の生化学検査によって、ADGRF5欠損マウスではアルブミン尿や腎機能の低下が生じていることも分かった。一般的に、受容体タンパク質は細胞外部の特定の刺激を受け取ると、その情報を細胞内部に伝達して遺伝子やタンパク質の働きを調節することで外部刺激に対する細胞応答を促すスイッチのような役割をする。そこで、ADGRF5が糸球体内皮細胞でどのような細胞応答に寄与するのかを調べるために、ヒトやマウスの糸球体内皮細胞の初代培養細胞に対して人為的にADGRF5の発現を抑制したところ、基底膜の構成分子(IV型コラーゲン)の遺伝子発現量の低下や血管機能の調節分子(KLF2)の遺伝子発現量の上昇が起こることを明らかにした。これらの結果から、ADGRF5が糸球体内皮細胞における遺伝子の働きを調節することで、糸球体ろ過障壁の構造とろ過機能を正常に保つ働きをしていることが示された。
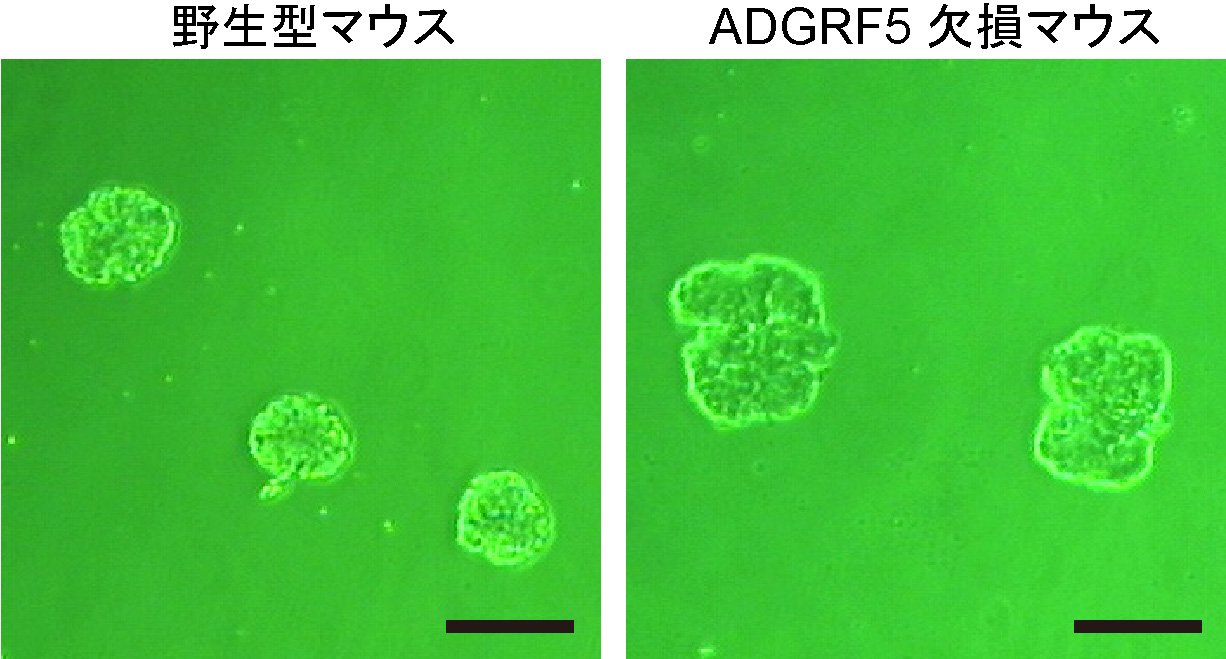
図2. マウスの腎臓から取り出した糸球体の写真
ADGRF5欠損マウスの糸球体(写真右)のサイズは、野生型マウスのもの(写真左)に比べて大きくなっていた。スケールバーはいずれも0.1ミリメートル。
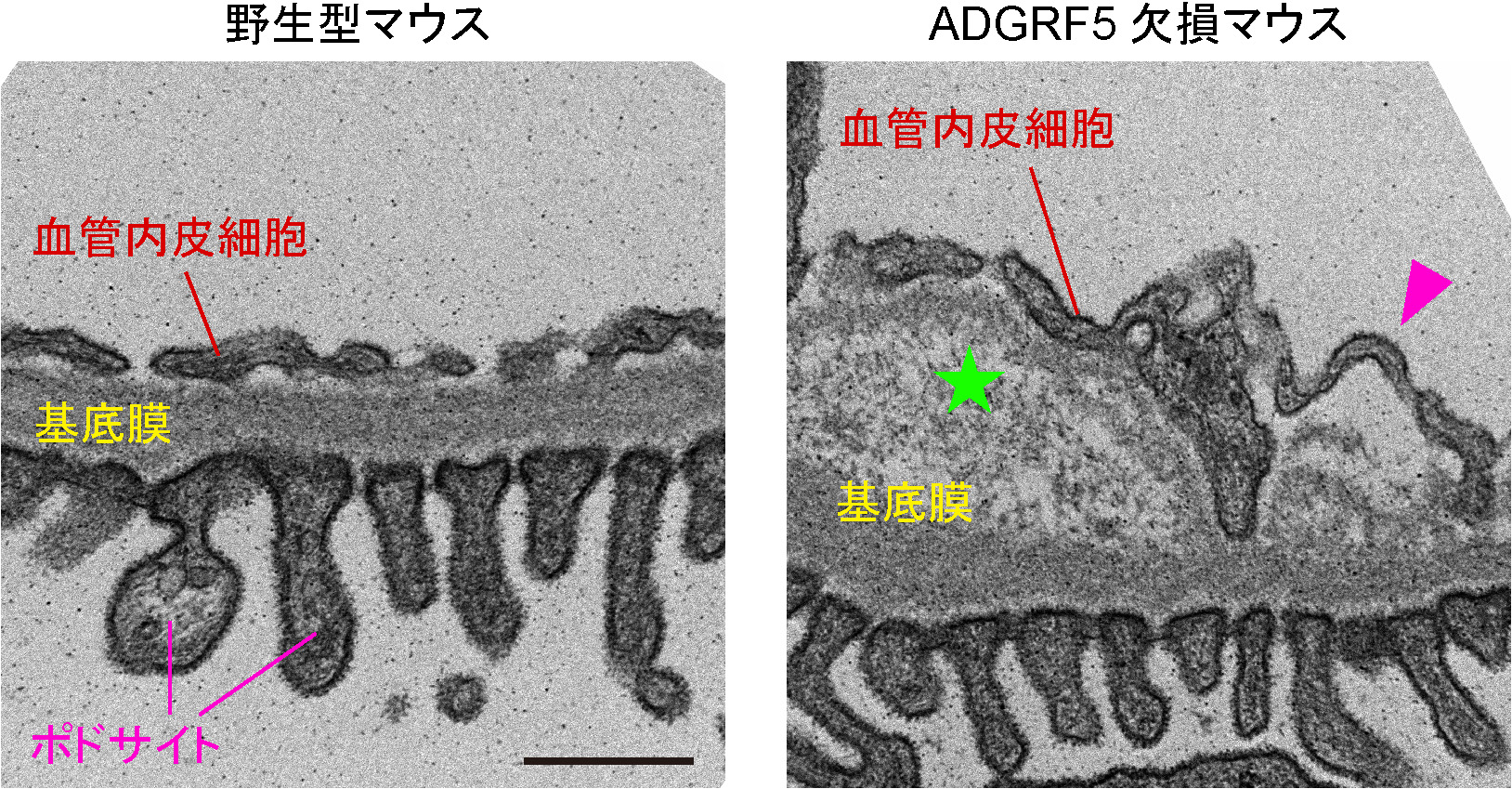
図3. マウスの糸球体ろ過障壁の断面写真
野生型マウス(写真左)とADGRF5欠損マウス(写真右)の糸球体ろ過障壁の断面を透過型電子顕微鏡で撮影した。野生型マウスの場合と比較して、ADGRF5欠損マウスでは糸球体内皮細胞の剥離(矢頭)や基底膜の断裂や肥厚(星印)が生じていて3層構造が壊れている様子が観察された。2枚の写真の拡大倍率は同じ。スケールバーは0.5マイクロメートル(1ミリメートルの2,000分の1)。
多くの腎疾患で糸球体障害が起こることが認められる。糸球体は一度壊れると再生できず、その機能を失ってしまう。したがって、病気が進行すると腎機能が徐々に失われていき、自分の腎臓では生命を維持することができなくなるため透析療法や腎移植といった治療を受ける必要がある。多くの場合、糸球体障害の原因や発症メカニズムが不明であるため、根本的な治療法が確立していないのが現状である。本研究で明らかにした新たな糸球体ろ過障壁の維持機構は、糸球体障害の発症メカニズムの解明への手掛かりとなり今後の研究の進展に貢献することが期待される。 これまでに、糸球体ろ過障壁の障害の発症メカニズムに関連する遺伝子やタンパク質がポドサイトで多く発見されてきた経緯があったため、糸球体内皮細胞の寄与については解析があまり進んでいない状況であった。本研究の成果が今後、糸球体内皮細胞に焦点を当てた研究が増えていくきっかけとなり、糸球体障害の分子メカニズムの理解につながることが期待される。
テーマ2.オルガネラ特異的なユビキチン化制御システムの生理機能の解明(テーマ1はこちら)
生命現象は多種多様なタンパク質の働きによって維持されており,個々のタンパク質の発現・細胞内局在・活性・構造は厳密に制御されている。この制御のしくみの一つとしてタンパク質翻訳後修飾であるユビキチン化が重要な役割を担っていることが知られている。私たちは,特定のオルガネラ膜に存在するユビキチン化制御分子を発見し,受容体などの膜タンパク質の発現量や細胞内局在の調節や決定に関与することを明らかにしている。オルガネラを介した新たなシグナル伝達や細胞内恒常性維持の機構があるものと考え,新発見のユビキチン化制御分子の機能解析を行っている。
主な研究テーマと成果1. ユビキチン化を介した膜融合調節
準備中です。2. ストレス応答に関与する新たな膜貫通型ユビキチン化酵素の機能解析
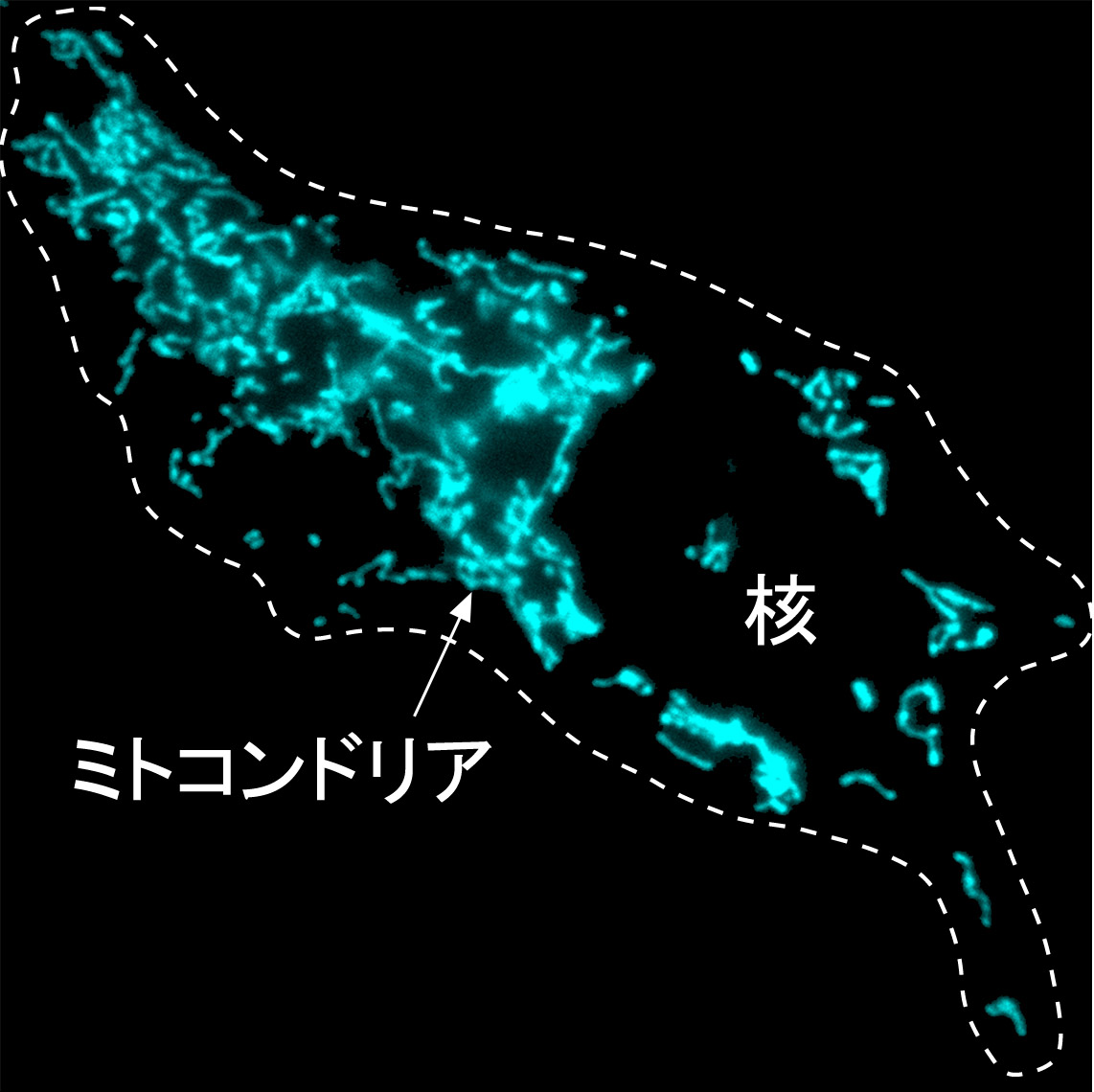
準備中です。3. ミトコンドリアの形態・機能制御
ミトコンドリアは絶えず形や細胞内分布をダイナミックに変化させている。この形態変化はミトコンドリア機能(エネルギー産生,アポトーシスなど)と密接な関係があり,形態調節の異常が神経変性疾患の原因となることから,ミトコンドリア形態制御の分子機構の解明が待たれている。私たちは哺乳動物ミトコンドリアのユビキチン化制御分子を同定し,ユビキチン化がミトコンドリア形態調節に働くことを見出している。現在,これらの分子の作用機構の解析を進めている。→日本語説明