Heart development & connexin
心臓発生の鍵を握る新分子の発見
働き者の心臓
心臓は、規則正しく拍動を繰り返して全身に血液を循環させるポンプとしてはたらく生命維持に欠くことのできない臓器です。心臓は1分間に70回拍動して約5リットルの血液を送り出します。これが50年続くと21億回も拍動を繰り返して大型タンカー一艘分に相当する血液を送り出していることになる訳ですから、この世の中で最も働き者という他ありません。
なぜこれほど働き続けられるのでしょうか?それは、心臓は筋肉でできているからなのです。心臓の筋肉(心筋)はたくさんの心筋細胞が集まってできていて、一つ一つの心筋細胞が一斉にタイミングを合わして収縮弛緩を繰り返して、心臓のポンプ機能を生み出しています。ではなぜ、心筋細胞は伸び縮みできるのか?その答えは細胞の中にあります。
すべての心筋細胞の中には、無数の筋原繊維と呼ばれる繊維状の構造物が、整然と同じ方向に向かって並んで束を作っています。この繊維の束が伸び縮みをすることで心筋細胞がはたらくことができます。(図1.左上の写真)
この心筋細胞の繊維の束は"筋原繊維"と呼ばれていて、心臓の筋肉の構造と収縮のしくみは今ではほとんど解かるようになています。しかしながら、ここには未だに誰も答えることのできない疑問があります。それは、拍動に不可欠な筋原繊維がいつ作られ始めて、繊維の向きがどのようにして決まるかということです。これまでに数多くの研究がなされたにも関わらず、明確な説明ができていない生物学上の難問のひとつになっています。
繊維をつくる新分子~コネキシンの発見
心臓は受精後まもなくに心筋細胞のもとになる前駆細胞から作られ始め、8週目までには大人とほぼ同じ形をした心臓が出きあがります。この前駆細胞から心筋細胞に変化する(生物学の言葉で分化するといいます)過程で、さまざまな遺伝子のはたらきで筋原繊維が出来上がることが知られています。簡単に説明しますと、前駆細胞の中で、心筋細胞への分化を促す遺伝子がはたらくと、これが直接、繊維を作るのに必要な遺伝子群を働かせるというものですが、詳しい仕組みについてはまだ十分に分かっていません。
私たちは、ゼブラフィッシュを用いた解析の過程で、筋原繊維形成の謎を解き明かす手掛かりとなる発見をしました。ゼブラフィッシュは小型の熱帯魚であり,臓器のでき方や構造が人間のものとよく似ています。また、成長がとても早く、3日でほとんどの臓器が完成し、しかも稚魚の体は透明なので臓器ができていく様子を顕微鏡で観察することができます。遺伝子操作が容易に行えるので、臓器の形成と遺伝子の働きとの関係を調べることも可能です。このような利点から、最近では臓器形成の研究の優れたモデル動物としてゼブラフィッシュが利用されています。
私たちのグループは過去に心臓の形と機能が異常であるゼブラフィッシュの変異体を見つけました(東工大の広瀬教授と川上准教授の共同研究)。見つけた変異体の心臓の心筋細胞の中を観察したところ、一方向に整列しているはずの筋原繊維がバラバラに乱れていることが分かりました(図1. 右上の写真)。この変異体の魚では何が起こっているのか詳しく調べたところ、ある一つの遺伝子の働きに異常があることが分かりました。

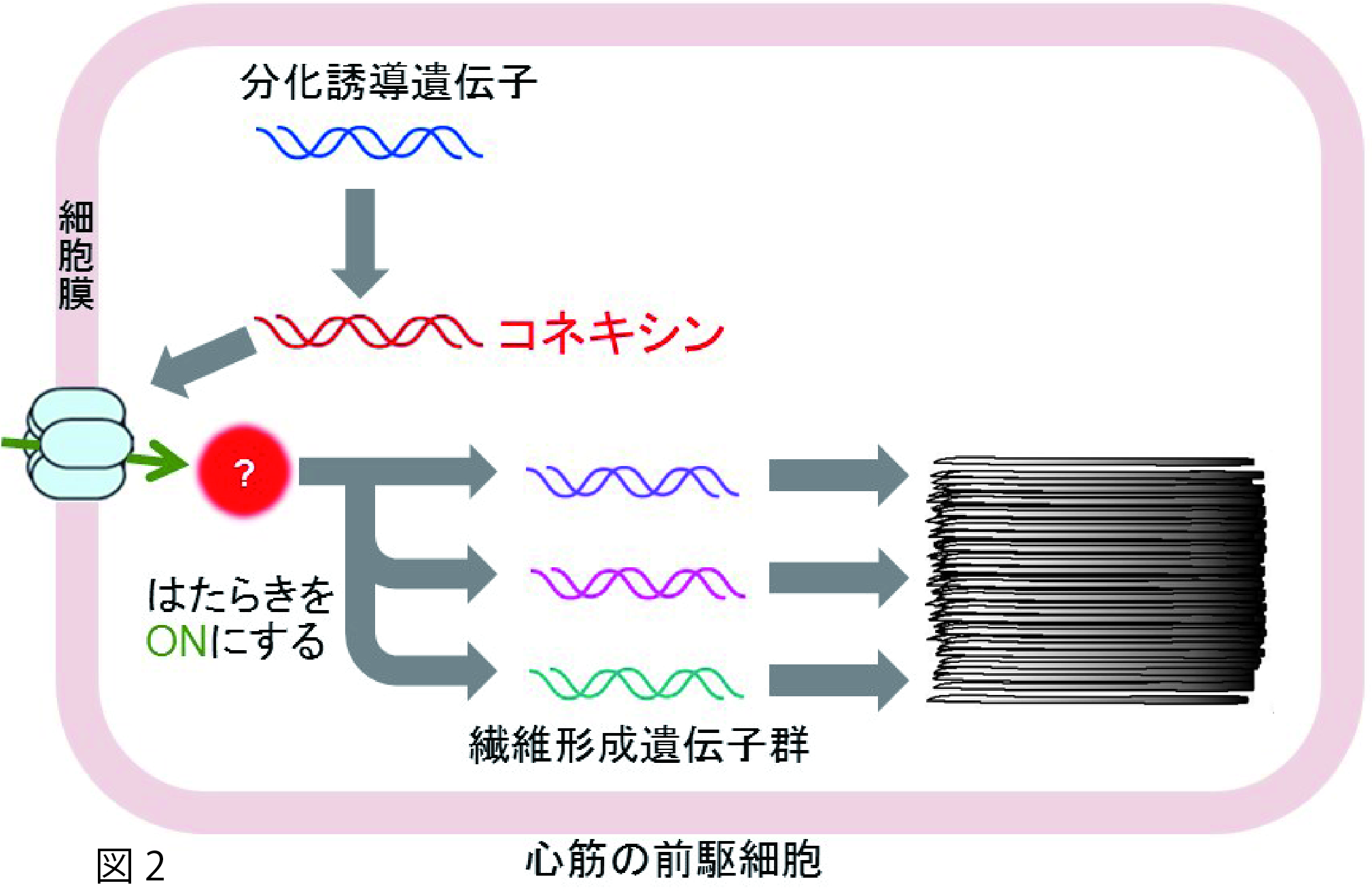
この遺伝子が正常にはたらくと、遺伝子の情報をもとにコネキシンと呼ばれるタンパク質がつくられます。コネキシンは筒状の分子で、非常に小さな分子(化学物質やイオンなど)が通ることができる大きさの穴をもっています。このコネキシンは細胞のへりに存在する性質がありますが、変異体では遺伝子の異常によりコネキシンの構造に変化が生じて細胞の中に留まってしまうことが分かりました。コネキシンは細胞の縁で細胞内外の物質輸送に働くことが予想され、変異体の魚で見られた筋原繊維の乱れは、この輸送が行えないために起こったものと考えられます。
このコネキシン遺伝子は発生途中の心臓でコネキシン遺伝子が働くことがわかり、さらに、コネキシン遺伝子を破壊すると繊維形成に関わる遺伝子が働かないことも見出しました。私たちの結果から、前駆細胞から心筋細胞に変化するごく初期の段階で、コネキシン遺伝子がはたらくことで、筋原繊維の方向を決める遺伝子群のはたらきを調整しているのではないかと考えています(図2)。今後の研究によって心筋細胞分化(筋原繊維形成)のしくみを解き明かしていくことで、いまだに原因が良く分かっていない心臓病の原因究明、診断法、再生医療などによる治療法の発展につながる情報を提供できると思っています。
現在は,このコネキシンが輸送する分子の実体解明と,筋原繊維形成に至るまでのシグナル伝達経路の解明を目指して解析を進めています。
参考論文
Zebrafish early cardiac connexin, Cx36.7/Ecx, regulates myofibril orientation and heart morphogenesis by establishing Nkx2.5 expression. Proc Natl Acad Sci USA105(12), 4763-4768, 2008 PMID: 18337497Sultana N, Nag K, Hoshijima K, Laird DW, Kawakami A, Hirose S
Heart development is a precisely coordinated process of cellular proliferation, migration, differentiation, and integrated morphogenetic interactions, and therefore it is highly susceptible to developmental anomalies such as the congenital heart disease (CHD). One of the major causes of CHD has been shown to be the mutations in key cardiac transcription factors, including nkx2.5. Here, we report the analysis of zebrafish mutant ftk that showed a progressive heart malformation in the later stages of heart morphogenesis. Our analyses revealed that the cardiac muscle maturation and heart morphogenesis in ftk mutants were impaired because of the disorganization of myofibrils. Notably, we found that the expression of nkx2.5 was down-regulated in the ftk heart despite the normal expression of gata4 and tbx5, suggesting a common mechanism for the occurrence of ftk phenotype and CHD. We identified ftk to be a loss-of-function mutation in a connexin gene, cx36.7/early cardiac connexin (ecx), expressed during early heart development. We further showed by a rescue experiment that Nkx2.5 is the downstream mediator of Ecx-mediated signaling. From these results, we propose that the cardiac connexin Ecx and its downstream signaling are crucial for establishing nkx2.5 expression, which in turn promotes unidirectional, parallel alignment of myofibrils and the subsequent proper heart morphogenesis.