Regulation of Mitochondrial Morphology
ミトコンドリアの形態制御機構の分子細胞生物学的な解析
ミトコンドリアは二重の生体膜からなる複雑な構造をもつ細胞小器官であり,細胞増殖・分化・応答に伴って驚くほど柔軟な形態・分布の変化をしています。1997年以降の酵母やショウジョウバエの解析により,ミトコンドリアの形態制御に関わる遺伝子が多数同定され,その幾つかは哺乳動物にも存在することが明らかにされました。なかでも,Fzo(酵母)/mitofusin(Mfn,哺乳類)およびDnm1(酵母)/Drp1(哺乳類)はそれぞれミトコンドリアの融合と分裂過程に働く因子として注目を集めています。Fzo/Mfnの活性を抑制するとミトコンドリアの断片化が誘導され,逆に,Dnm1/Drp1の活性を抑制するとミトコンドリアの融合反応が促進されることが報告されています。したがって,絶えず分裂と融合を繰り返しているミトコンドリアの膜構造の動的な変化は,ミトコンドリア融合・分裂因子の活性のバランスの変化で調節されているものと考えることができます。しかしながら,その活性調節の分子メカニズムについてははっきりしていません。
① Mfn2とDrp1の結合因子の同定:ユビキチン化によるミトコンドリアの形態制御 (EMBO Rep. 7, Nakamura et al.)
当研究室で同定した新規E3ユビキチン化酵素ファミリー(MARCH)分子のうち,MARCH-Vがミトコンドリア外膜に存在する膜貫通タンパク質であることを明らかにした。MARCH-Vのユビキチン化のターゲット分子を同定するため,ヒトHeLa細胞からMARCH-Vを免疫沈降し,相互作用するタンパク質の探索を行った。その結果,Mfn2とDrp1が共沈することを突き止め,さらにDrp1はユビキチン化されていることが分かった。共発現系の解析からMARCH-VはDrp1をE3活性の基質として認識してユビキチン化することを認め,E3活性中心であるRINGフィンガードメインに変異を導入するとDrp1のユビキチン化が認められなかった。MARCH-Vを哺乳類培養細胞に過剰発現するとミトコンドリアの伸長が起こり,RINGフィンガーに変異が入ったMARCH-Vを発現させると逆にミトコンドリアの断片化を誘導した。以上の結果は,MARCH-VがMfn2およびDrp1の活性調節因子としてミトコンドリアの融合と分裂の両方の反応を制御している可能性を示唆するものであり,その制御機構にユビキチン化が深く関与していることが考えられる。
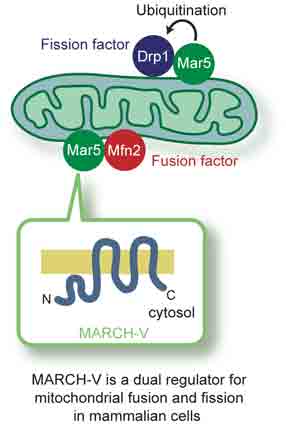
MARCH-V is a novel mitofusin 2- and Drp1-binding protein able to change mitochondrial morphology. EMBO Rep.7 (10), 1019-1022. 2006 PMID: 16936636
Nakamura N, Kimura Y, Tokuda M, Honda S, and Hirose S.
Mitofusins and Drp1 are key components in mitochondrial membrane fusion and division, but the molecular mechanism underlying the regulation of their activities remains to be clarified. Here, we identified human membrane-associated RING-CH (MARCH)-V as a novel transmembrane protein of the mitochondrial outer membrane. Immunoprecipitation studies demonstrated that MARCH-V interacts with mitofusin 2 (MFN2) and ubiquitinated forms of Drp1. Overexpression of MARCH-V promoted the formation of long tubular mitochondria in a manner that depends on MFN2 activity. By contrast, mutations in the RING finger caused fragmentation of mitochondria. We also show that MARCH-V promotes ubiquitination of Drp1. These results indicate that MARCH-V has a crucial role in the control of mitochondrial morphology by regulating MFN2 and Drp1 activities.
② ミトコンドリア脱ユビキチン化酵素の同定 (Mol. Biol. Cell 19, Nakamura & Hirose)
これまでに,ユビキチン・プロテアソーム系の分子がミトコンドリアの形態維持に重要であることが多数報告され,タンパク質翻訳後修飾であるユビキチン化がミトコンドリア形態調節機構のひとつとして機能することが示唆されてきた。しかしながら,ミトコンドリアにおけるユビキチン化がどのようにして制御されているかについては明らかにされていない。本研究では,USP30をミトコンドリア外膜に局在する膜貫通型の脱ユビキチン化酵素として同定した。USP30の発現量をRNA干渉法によって低下させると,ミトコンドリアの伸張が生じることを認めた。この形態変化は,USP30を過剰発現させることで抑制できたのに対して,酵素活性を失ったUSP30の過剰発現では抑制できなかった。以上から,USP30が脱ユビキチン化反応を通してミトコンドリアの形態維持に寄与することが考えられる。また,ミトコンドリア融合・分裂反応がユビキチン化・脱ユビキチン化によって可逆的に制御を受けている可能性が考えられる。
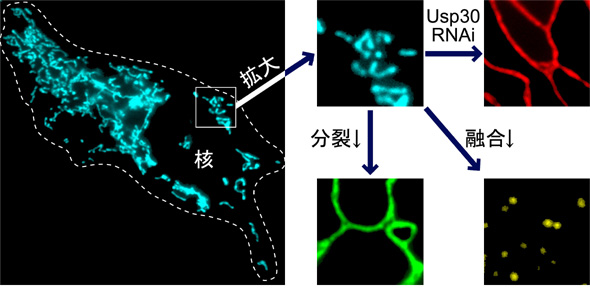
【写真の説明】ヒトの細胞(点線で囲っている部分)の内部にあるミトコンドリアを観察したもので,水色の糸くずのように見えるのがミトコンドリアです。このように細胞内には色々な形や大きさのミトコンドリアがたくさん存在しています。ほとんどの細胞にあるミトコンドリアは,分裂したり,他のミトコンドリアと融合することによって,自身の形態を絶えず変化させています。ミトコンドリアの分裂に働くタンパク質(Drp1)の量を減らすと,ミトコンドリアは分裂できなくなって,非常に細長くのびたような形をとります(右の拡大写真;緑色)。反対に,ミトコンドリアの融合に働くタンパク質(Mfn)の量を減らすと,ミトコンドリアは融合できなくなって,小さなツブツブのような形をとります(黄色)。ミトコンドリアの形態変化は,細胞や組織の生存や機能に重要であると考えられていますが,その仕組みについての分子レベルでの説明についてはまだ十分にされていません。ミトコンドリアタンパク質USP30は,その発現量を低下させるとミトコンドリアの形が大きく変化することから(赤色),ミトコンドリアの形態調節に関わっていることが期待されます。
Regulation of Mitochondrial Morphology by USP30, a Deubiquitinating Enzyme Present in the Mitochondrial Outer Membrane. Mol. Biol. Cell 19(5), 1903-1911. 2008 PMID: 18287522Nakamura N and Hirose S.
Recent studies have suggested that ubiquitination of mitochondrial proteins participates in regulating mitochondrial dynamics in mammalian cells, but it is unclear whether deubiquitination is involved in this process. Here, we identify human ubiquitin-specific protease 30 (USP30) as a deubiquitinating enzyme that is embedded in the mitochondrial outer membrane. Depletion of USP30 expression by RNA interference induced elongated and interconnected mitochondria, depending on the activities of the mitochondrial fusion factors mitofusins, without changing the expression levels of the key regulators for mitochondrial dynamics. Mitochondria were rescued from this abnormal phenotype by ectopic expression of USP30 in a manner dependent on its enzymatic activity. Our findings reveal that USP30 participates in the maintenance of mitochondrial morphology, which finding provides a new insight into the cellular function of deubiquitination.
③ マウス精子形成過程で発現するミトコンドリアタンパク質の同定 (Biol. Reprod. 80, 762-770, Aihara et al.)
ミトコンドリアの融合・分裂因子の相互作用因子の探索を行う過程で,GGNBP1を同定した。マウスGGNBP1は精巣特異的な発現を示し,分化途中の精母細胞と精子細胞に高発現してミトコンドリアに局在していることを認めた。培養細胞COS-7を用いた解析から,GGNBP1はミトコンドリアの膜間スペースに局在して,ミトコンドリアの分裂を促進することが分かった。精子形成時にミトコンドリアはその形態・局在・数を変化させていることが知られている。特に,多いエネルギー(ATP)を必要とする減数分裂時にはミトコンドリアの数が増加しその膜構造が変化することが報告されていることから,GGNBP1はこのミトコンドリアの形態変化に関与して精子形成をたすけていることが考えられる。
A Novel Potential Role for Gametogenetin-Binding Protein 1 (GGNBP1) in Mitochondrial Morphogenesis During Spermatogenesis of Mice. Biol. Reprod. 80(4), 762-770. 2009 PMID: 19208545Aihara T, Nakamura N, Honda S, and Hirose S.
Mitochondria are dynamic organelles that undergo fusion, fission, and translocation. The dynamic property is essential for establishing energy-consuming biological processes including cellular differentiation. Early ultrastructural studies have shown that mitochondria of mammalian spermatogenic cells dramatically change their number, size, distribution, and internal structure. However its regulatory mechanism is largely unknown. In course of searching for molecules involved in the mitochondrial morphogenesis in spermatogenesis, we identified mouse gametogenetin-binding protein 1 (GGNBP1), a DUF1055 domain-containing protein of unknown function, as a mitochondrial protein. When GGNBP1 was expressed in COS7 cells, it was localized in the intermembrane space and induced an extensive fragmentation of mitochondria in the manner dependent on the activity of the mitochondrial fission factor DNM1L. Deletion mutant analyses demonstrated that the N-terminal region is required for its mitochondrial targeting and the C-terminal region including the DUF1055 domain is responsible for the mitochondrial fragmentation activity. Immunohistochemistry of mouse testis revealed that GGNBP1 is highly expressed in the late pachytene spermatocytes and early round spermatids. However a subcellular fractionation study showed that it is localized to not only mitochondria but also other membranous compartments in vivo. These results suggest that GGNBP1 is involved in spermatogenesis by modifying mitochondrial dynamics and morphology.